新GSP四項(xiàng)關(guān)鍵內(nèi)容調(diào)整 將電子監(jiān)管系統(tǒng)改為藥品追溯體系
發(fā)布時(shí)間:2016-07-22 來源:佚名
2016年7月20日,CFDA出臺新法規(guī)文件《國家食品藥品監(jiān)督管理總局關(guān)于修改<藥品經(jīng)營質(zhì)量管理規(guī)范>的決定》(國家食品藥品監(jiān)督管理總局令第28號)。
回顧新版《藥品經(jīng)營質(zhì)量管理規(guī)范》的修訂歷程,自原衛(wèi)生部2013年6月1日施行的《藥品經(jīng)營質(zhì)量管理規(guī)范》(中華人民共和國衛(wèi)生部令第90號)開始,至今共修訂兩次。第一次為2015年7月1日,CFDA發(fā)布的《藥品經(jīng)營質(zhì)量管理規(guī)范》(國家食品藥品監(jiān)督管理總局令第13號),第二次即為本次總局第28號令。
那么,經(jīng)過兩次修訂,《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP)內(nèi)容具體發(fā)生了什么變化?根據(jù)筆者理解,總結(jié)如下幾點(diǎn):
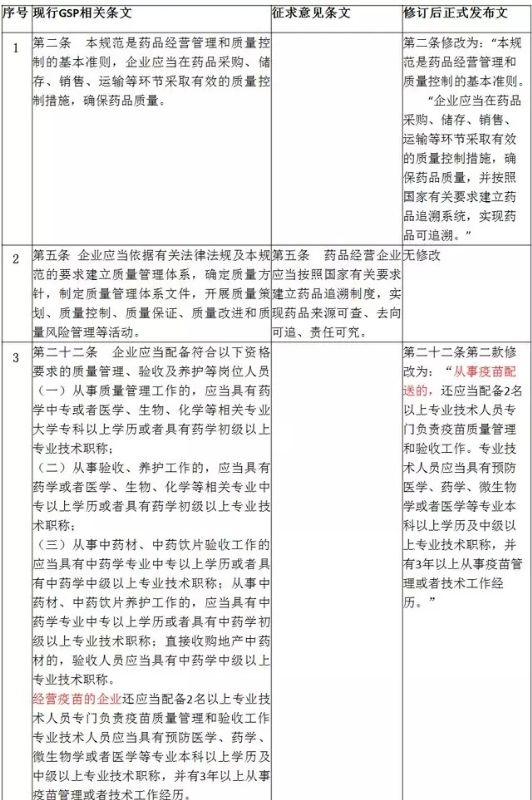
1首營企業(yè)資料收集變動
在2015年7月1日的第一次《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP)修訂中,調(diào)整主要內(nèi)容便是首營企業(yè)資料收集要求,將“營業(yè)執(zhí)照年檢證明”替換為“上一年度企業(yè)年度報(bào)告公示情況”,適應(yīng)工商部門調(diào)整營業(yè)執(zhí)照年度報(bào)告制度。
該資料要求調(diào)整后,藥品經(jīng)營企業(yè)需修訂企業(yè)質(zhì)量管理體系文件,相應(yīng)調(diào)整首營企業(yè)資料收集要求,并及時(shí)收集該項(xiàng)資料審核歸檔。另外,根據(jù)《國務(wù)院辦公廳關(guān)于加快推進(jìn)“三證合一”登記制度改革的意見》(國辦發(fā)[2015]50號),首營企業(yè)資料收集中,調(diào)整為“營業(yè)執(zhí)照、稅務(wù)登記、組織機(jī)構(gòu)代碼證復(fù)印件”。
2“疫苗經(jīng)營企業(yè)相關(guān)要求”調(diào)整為“疫苗配送企業(yè)要求”
2016年3月,由于發(fā)生疫苗事件,疫苗質(zhì)量管理引起國家各執(zhí)政部門高度重視,國務(wù)院于2016年4月份修訂了《疫苗流通和預(yù)防接種管理?xiàng)l例》(中華人民共和國國務(wù)院令第668號),規(guī)定疫苗生產(chǎn)企業(yè)直接向縣級疾病預(yù)防控制機(jī)構(gòu)配送第二類疫苗,或者委托具備冷鏈儲存、運(yùn)輸條件的企業(yè)配送,減少疫苗多次經(jīng)營流轉(zhuǎn),降低由于運(yùn)輸、貯存溫濕度監(jiān)控不當(dāng)所造成的對疫苗質(zhì)變的風(fēng)險(xiǎn)。
本次新修訂《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP)中,適應(yīng)國務(wù)院新管理?xiàng)l例的內(nèi)容,嚴(yán)格監(jiān)管疫苗質(zhì)量管理,具備疫苗經(jīng)營范圍且受疫苗生產(chǎn)企業(yè)委托配送的經(jīng)營企業(yè),仍需嚴(yán)格按照新修訂《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP)第二十二條規(guī)定配置相應(yīng)人員。
3電子監(jiān)管系統(tǒng)調(diào)整為藥品追溯體系
2016年2月20日,CFDA發(fā)布《總局關(guān)于暫停執(zhí)行2015年1號公告藥品電子監(jiān)管有關(guān)規(guī)定的公告》(2016年第40號),暫停了藥品生產(chǎn)經(jīng)營企業(yè)國家電子監(jiān)管相關(guān)工作。暫停期間,多個(gè)藥品經(jīng)營企業(yè)人員也曾咨詢筆者,是否還需繼續(xù)執(zhí)行國家電子監(jiān)管碼“見碼掃,數(shù)據(jù)上傳”工作?是否真的完全取消電子監(jiān)管碼,那么取消之后如何實(shí)現(xiàn)藥品追溯性?
本次新修訂《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP),調(diào)整幅度最大的內(nèi)容便是國家電子監(jiān)管相關(guān)規(guī)定,調(diào)整后法規(guī)中提出新字眼“藥品追溯”,對藥品流通環(huán)節(jié)中藥品經(jīng)營企業(yè)如何執(zhí)行藥品追溯制度提出操作性要求,新修訂《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP)中,明確“企業(yè)應(yīng)當(dāng)在藥品采購、儲存、銷售、運(yùn)輸?shù)拳h(huán)節(jié)采取有效的質(zhì)量控制措施,確保藥品質(zhì)量,并按照國家有關(guān)要求建立藥品追溯系統(tǒng),實(shí)現(xiàn)藥品可追溯”“企業(yè)應(yīng)當(dāng)建立能夠符合經(jīng)營全過程管理及質(zhì)量控制要求的計(jì)算機(jī)系統(tǒng),實(shí)現(xiàn)藥品可追溯。”
4強(qiáng)化冷鏈管理
本次新修訂《藥品經(jīng)營質(zhì)量管理規(guī)范》(GSP)中,強(qiáng)化對于冷藏、冷凍藥品溫濕度控制要求,明確冷藏、冷凍藥品在貯存、運(yùn)輸過程當(dāng)中,必須配置相應(yīng)的設(shè)施設(shè)備,確保全過程冷鏈管理。同樣,目的是降低由經(jīng)營流通環(huán)節(jié)種由于經(jīng)營企業(yè)溫濕度控制工作執(zhí)行不到位而造成冷鏈產(chǎn)品質(zhì)變的風(fēng)險(xiǎn),確保使用患者生命安全。
現(xiàn)行《藥品經(jīng)營質(zhì)量管理規(guī)范》、2月20日修訂草案、新修訂后正式發(fā)布稿的變化